致命實體腫瘤,CAR-T曙光已現
導覽
2024年4月5日-10日,第115屆美國癌癥研究協會(American Association for Cancer Research, AACR)年會在美國圣地亞哥舉行,這次盛會吸引了來自世界各地的近20,000名專業人士,共同分享和探討癌癥治療研究的最新進展。AACR是全球最早成立且規模最大的癌癥研究科學組織,致力于推動全面、創新和高水準的癌癥研究。它與美國臨床腫瘤學會(ASCO)和歐洲腫瘤內科學會(ESMO)一同被公認為全球三大癌癥學會。
斯丹賽生物技術有限公司(以下簡稱斯丹賽),是一家專注于開發實體瘤CAR-T細胞治療產品的臨床階段生物技術公司,公司受邀參加了本次AACR年會,并以壁報形式展示了基于自主研發的CoupledCAR平臺技術開發的實體腫瘤領先療法GCC19CART的美國I期臨床試驗進展,該產品被開發用于治療復發/難治性轉移性結直腸癌(R/R mCRC)患者。
美國臨床研究醫生Bridget Keenan博士會后在推特平臺上發表評論,稱贊GCC19CART是“絕望疾病的希望之光”。
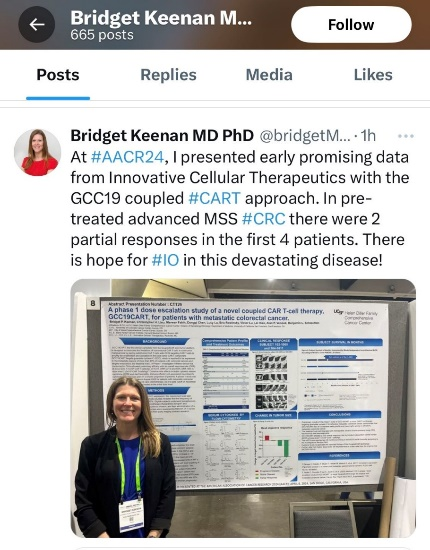
美國臨床研究醫生Bridget Keenan博士會后發布的推特動態
斯丹賽參會信息
·摘要標題:A phase 1 dose escalation study of a novel coupled CAR T cell therapy, GCC19CART, for patients with metastatic colorectal cancer
·會議環節:0期和I期臨床試驗
·時間:美國當地時間2024年4月8日,1:30PM-5:00PM
·位置:壁報區49
·壁報編號:8
·摘要展示號:CT129
·摘要內容概述:
GCC19CART是以GCC為靶點,專門設計用于靶向治療晚期結直腸癌的一款自體CAR-T產品。一項在中國進行的由研究者發起的多中心I期劑量爬坡臨床試驗顯示,根據實體腫瘤療效評價標準(RECIST1.1),GCC19CART低劑量組(1x10^6 CAR-T/kg)客觀緩解率(ORR)為15.4%(2/13),中劑量組(2x10^6 CAR-T/kg)的ORR為50%(4/8)。
2022年8月GCC19CART在美國啟動Ⅰ期臨床試驗,截至2023年11月1日(數據截止日期),劑量水平1(1x10^6 CAR-T/kg)已完成入組(劑量水平1為低劑量水平),共有4名受試者接受回輸治療并完成評估。影像學結果由獨立的美國第三方影像學評估機構進行評估,按照RECIST1.1標準,獨立審查的ORR為50%(2/4),2名受試者表現出部分緩解(PR)。基于臨床醫生的評估,劑量水平1的中位無進展生存期(PFS)為3.8個月;劑量水平2(2x10^6 CAR T/kg)正在進行中。
結論:美國I期臨床研究的初步結果表明,GCC19CART在復發/難治性轉移性結直腸癌中具有顯著的臨床療效和良好的安全性,結合中國的臨床試驗數據可以看出,臨床療效與劑量呈正相關。該試驗仍在進行中,臨床試驗信息:NCT05319314。
結直腸癌:巨大的未被滿足的醫療和市場需求
最新的全球癌癥負擔數據顯示,2022年全球預計有近2000萬新發癌癥病例,常見新發癌癥中,腸癌位居第3,約192萬;全球癌癥死亡病例估計為970萬,其中腸癌占比第2,約90.2萬。根據相關統計,中國每年約28.6萬人死于結直腸癌,癌癥死亡率排名第4;美國每年約5.4萬人死于結直腸癌,死亡率排名第2。這些令人擔憂的數據背后反映出了龐大的醫療和市場需求。
治愈的曙光:全球領先的CoupledCAR專有實體瘤CAR-T平臺
目前,全球已有9款CAR-T療法獲批,但都是用于治療血液瘤,CAR-T治療實體瘤仍有待突破。
這歸結以下幾方面:實體瘤CAR-T體內擴增困難、對腫瘤組織的浸潤不足、腫瘤微環境的免疫抑制以及實體瘤安全有效的靶點少等問題。針對這些問題,斯丹賽通過不斷更新迭代技術,打造了專攻實體瘤CAR-T的CoupledCAR平臺技術,并結合新篩選出的腫瘤特異表達且安全的靶點,來治療多種實體瘤。斯丹賽在CAR-T技術領域擁有三百余項全球專利及專利申請,處于國際領先水平。
GCC19CART是斯丹賽基于該平臺技術研發的首發候選產品,目前斯丹賽是全球唯一一個使用CAR-T治療結直腸癌有良好臨床數據的公司,在充分的臨床試驗數據的支持下,斯丹賽有望提供全球第一個被批準上市的治療結直腸癌的CAR-T產品。
除結直腸癌外,CoupledCAR技術在前列腺癌臨床試驗中也展現出臨床療效。以PAP 為靶點的前列腺癌產品PAPCART正在推進國內臨床試驗,已回輸的5例受試者中有4例達到了PSA應答(注:PSA應答指前列腺癌特異標志物PSA水平和基線相比,下降 50%以上)。前列腺癌產品的療效進一步證明了CoupledCAR 作為平臺技術的可擴展性很好,未來可以治療更多其他適應癥,惠及更多病人。
關于斯丹賽
斯丹賽生物技術有限公司是一家專注于開發實體瘤CAR-T細胞治療產品的臨床階段生物技術公司。斯丹賽獨特的CoupledCAR平臺技術旨在克服治療實體瘤的關鍵挑戰,基于該平臺技術開發的CAR-T產品已經在治療晚期實體瘤(如結直腸癌)中取得了可喜的臨床結果。公司針對晚期結直腸癌的CAR-T細胞治療產品GCC19CART于2021年8月獲得了美國食品和藥物管理局(FDA)的臨床試驗批件,并于2022年4月獲得FDA授予的快速通道資格,目前美國臨床試驗正在進行中。斯丹賽同時也在布局針對其它實體瘤(包括前列腺癌、胰腺癌等)的豐富的CAR-T候選藥物管線。欲了解更多信息,請訪問www.ictbio.com。
投資者聯系方式
郵箱:ir@ictbioinc.com
聯系電話:021-58959719















